OPTEL erläutert das Gesetz zur Sicherheit der Arzneimittelversorgungskette
Gefälschte Arzneimittel sind ein seit langem bestehendes globales Problem, und die USA trifft es vielleicht am schlimmsten. Nach Angaben des PSI (Pharma Security Institute) sind die Fälle von gefälschten, gestohlenen und illegal abgezweigten Arzneimitteln im Jahr 2019 auf ein Allzeithoch von 4.405 weltweit, doppelt so viele wie im Jahr 2014, gestiegen. Nordamerika verzeichnete die meisten Beschlagnahmungen (1.750) aufgrund von gefälschten Arzneimitteln im Jahr, gefolgt von Asien.
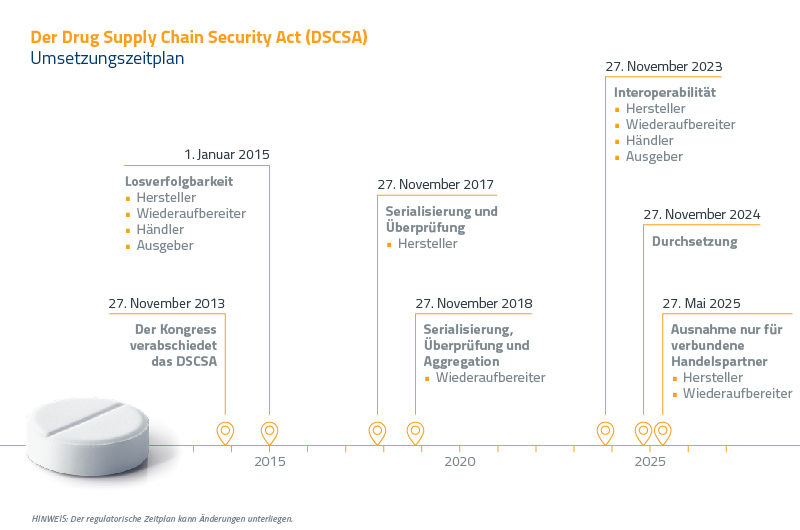
Um dieses wachsende Problem zu bekämpfen und die Sicherheit der Arzneimittelvertriebskette zu stärken, führte die FDA den Drug Supply Chain Security Act (DSCSA) ein. Das Gesetz wurde vom damaligen Präsidenten Obama am 27. November 2013 unterzeichnet und folgt einem zehnjährigen, schrittweisen Umsetzungsplan mit jährlichen Compliance-Fristen.
Die FDA gewährt eine Ausnahme für verbundene Handelspartner. Diese Ausnahme gilt für Produkte, die von berechtigten Handelspartnern gehandhabt werden: diejenigen, die entweder erfolgreich Datenverbindungen mit ihren unmittelbaren Handelspartnern hergestellt haben oder dokumentierte Bemühungen unternommen haben, solche Verbindungen herzustellen, aber weiterhin Schwierigkeiten beim Datenaustausch haben. Die neue Frist für Hersteller und Umpacker ist auf den 27. Mai 2025 festgelegt.
Wenn Sie in der Pharmaindustrie tätig sind, ist ein Verständnis dieses entscheidenden Gesetzes und seiner Auswirkungen unerlässlich, um die DSCSA-Bereitschaft Ihres Unternehmens zu beurteilen.
WAS IST DER DRUG SUPPLY CHAIN SECURITY ACT (DSCSA)?
Im Jahr 2004 hat der US-Bundesstaat Kalifornien die ersten Schritte unternommen, um verschreibungspflichtige Arzneimittel für Patienten sicher zu machen, wobei die Serialisierung im Mittelpunkt dieser Bemühungen stand. Alle Arzneimittelhersteller und Zulieferer im Bundesstaat waren verpflichtet, für jedes Produkt, das sich durch die Lieferkette bewegte, einzelne Verpackungen zu serialisieren und einen elektronischen Herkunftsnachweis vorzulegen.
Die Idee hinter dieser Initiative war, Fälschungen einfach erkennen zu können und bei Bedarf Rückrufaktionen zu starten.
Nach dem offensichtlichen Erfolg des Verfahrens in Kalifornien hat die FDA eine landesweite Lösung gegen gefälschte Arzneimittel in Form des Drug Supply Chain Security Act (DSCSA) beantragt.
Im Wesentlichen legt das Gesetz grundlegende Anforderungen für den Aufbau eines vollständigen elektronischen Systems zur Verfolgung und Identifizierung von verschreibungspflichtigen Arzneimitteln fest, die in den USA verkauft werden. Das Gesetz sieht Folgendes vor:
- Den interoperablen, elektronischen Austausch von Transaktionserklärungen und Transaktionsinformationen zwischen Mitgliedern einer pharmazeutischen Lieferkette
- Die interoperable Rückverfolgung von Transaktionserklärungen und Transaktionsinformationen an den Hersteller für jede verkaufte Einheit
- Die interoperable Verifizierung der Produktkennung, einschließlich Seriennummer, Chargennummer, GTIN/NDC und Ablaufdatum
Der Schwerpunkt liegt hier auf der Interoperabilität. Der DSCSA hat das Ziel, einen reibungslosen, sicheren und vertraulichen Datenfluss zwischen Handelspartnern zu gewährleisten.