OPTEL détaille la loi sur la sécurité de la chaîne d’approvisionnement en médicaments
La contrefaçon de médicaments est un problème mondial de longue date, et c’est peut-être aux États-Unis qu’elle est la plus répandue. Selon le PSI (Pharma Security Institute), les cas de contrefaçon, de vol et de détournement de médicaments ont atteint le chiffre record de 4 405 dans le monde en 2019, soit deux fois plus qu’en 2014. L’Amérique du Nord a connu le plus grand nombre de saisies (1 750) de médicaments contrefaits au cours de l’année, suivie par l’Asie.
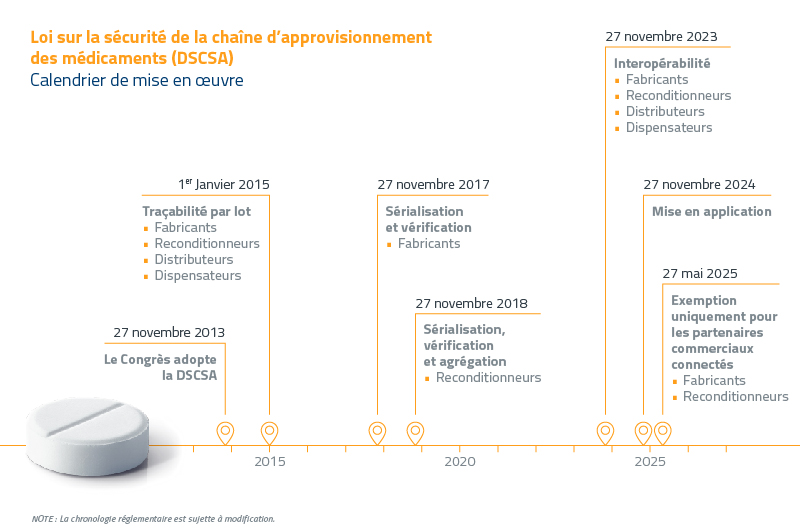
Pour lutter contre ce problème croissant et renforcer la sécurité de la chaîne de distribution des médicaments, la FDA a introduit la loi sur la sécurité de la chaîne d’approvisionnement en médicaments (DSCSA). Signée par le Président Obama de l’époque le 27 novembre 2013, la loi suit un plan de mise en œuvre échelonné sur 10 ans, avec des échéances de conformité annuelles. Certaines échéances coûteuses et difficiles sont déjà derrière nous.
La FDA accorde une exemption aux partenaires commerciaux connectés. Cette exemption s’applique aux produits gérés par des partenaires commerciaux éligibles : ceux qui ont soit établi avec succès, soit fait des efforts documentés pour établir des connexions de données avec leurs partenaires commerciaux immédiats, mais qui continuent à rencontrer des difficultés dans l’échange de données. La nouvelle date limite pour les fabricants et les reconditionneurs est fixée au 27 mai 2025. Si vous appartenez à l’industrie pharmaceutique, il est essentiel de comprendre cette loi cruciale et ses implications pour évaluer dans quelle mesure votre organisation est prête pour la DSCSA.
Nous vous présentons un guide complet de la DSCSA, les échéances cruciales et les prescriptions.
QU’EST-CE QUE LA LOI SUR LA SÉCURITÉ DE LA CHAÎNE D’APPROVISIONNEMENT EN MÉDICAMENTS (DSCSA) ?
En 2004, l’État de Californie a pris les premières mesures pour rendre les médicaments sur ordonnance plus sûrs pour les patients, la sérialisation étant au centre de ces efforts. Tous les fabricants et fournisseurs de produits pharmaceutiques de l’État étaient tenus de sérialiser les emballages individuels et de fournir une preuve électronique de l’origine de chaque produit circulant dans la chaîne d’approvisionnement.
L’idée derrière cette initiative était de faciliter la détection des contrefaçons et de lancer des rappels si nécessaire.
Face au succès de cette méthode en Californie, la FDA a préconisé une solution nationale contre la contrefaçon des médicaments sous la forme de la loi sur la sécurité de la chaîne d’approvisionnement en médicaments (DSCSA).
En substance, cette loi définit les conditions essentielles à la mise en place d’un système électronique complet de suivi et d’identification des médicaments sur ordonnance en vente aux États-Unis. La loi prévoit ce qui suit :
- L’échange électronique interopérable de relevés et d’informations transactionnels entre les membres d’une chaîne d’approvisionnement pharmaceutique
- La traçabilité interopérable des relevés et informations transactionnels jusqu’au fabricant pour chaque unité vendue
- La vérification interopérable de l’identificateur du produit, y compris le numéro de série, le numéro de lot, le GTIN/NDC et la date d’expiration
L’accent est mis ici sur l’interopérabilité. La DSCSA s’efforce de fournir un flux de données fluide, sécurisé et confidentiel entre les partenaires commerciaux.