OPTEL detalha a lei sobre a segurança da cadeia de abastecimento de medicamentos
A falsificação de medicamentos é um problema global de longa data e talvez os EUA tenham a pior parte. De acordo com o PSI (Pharma Security Institute, Instituto de Segurança Farmacêutica), os casos de falsificação, roubo e desvio ilegal de medicamentos alcançaram a cifra recorde de 4.405 em todo o mundo em 2019, o dobro dos casos observados em 2014. A América do Norte teve o maior número de apreensões (1.750) devido a medicamentos falsificados durante o ano, seguida pela Ásia.
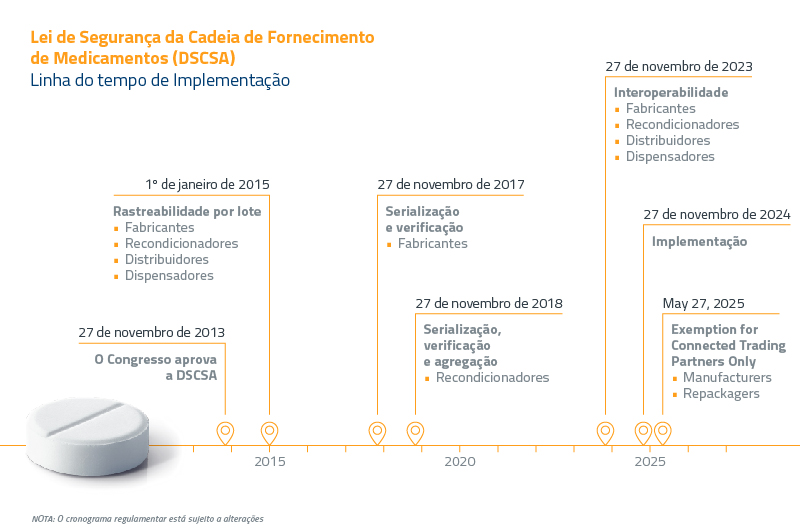
Para combater esse problema crescente e reforçar a segurança da cadeia de distribuição de medicamentos, a FDA apresentou a Lei de segurança da cadeia de suprimentos de medicamentos (DSCSA). Assinada pelo então presidente Obama em 27 de novembro de 2013, a lei segue um plano de implementação em fases durante 10 anos, com prazos de conformidade anuais. Já deixamos atrás alguns desses prazos custosos e desafiantes.
A FDA concede uma isenção aos Parceiros Comerciais Conectados. Essa isenção se aplica aos produtos manejados por parceiros comerciais elegíveis: aqueles que estabeleceram com sucesso ou realizaram esforços documentados para estabelecer conexões de dados com seus parceiros comerciais imediatos, mas continuam enfrentando desafios na troca de dados. O novo prazo para fabricantes e recondicionadores está definido para 27 de maio de 2025.
Se você faz parte do setor farmacêutico, compreender essa lei fundamental e suas implicações é essencial para avaliar a prontidão de sua organização perante a DSCSA.
Apresentamos a seguir um guia completo da DSCSA, com os principais prazos e exigências obrigatórias.
O QUE É A LEI DE SEGURANÇA DA CADEIA DE SUPRIMENTOS DE MEDICAMENTOS (DSCSA)?
Em 2004, o estado da Califórnia tomou as primeiras medidas para tornar os medicamentos que exigem receita médica seguros para os pacientes, sendo que a serialização estava no centro dessa iniciativa. Todos os fabricantes farmacêuticos e fornecedores do estado foram obrigados a serializar embalagens individuais e fornecer uma prova eletrônica da origem de cada produto que se movimentava pela cadeia de suprimentos.
A ideia por trás dessa iniciativa era facilitar a detecção de falsificações e iniciar retiradas caso necessário.
Após observar o sucesso do método na Califórnia, a FDA solicitou formalmente uma solução nacional para a falsificação de medicamentos na forma da Lei de segurança da cadeia de suprimentos de medicamentos (DSCSA).
Essencialmente, a lei estabelece exigências vitais para construir um sistema eletrônico para o rastreamento e identificação de medicamentos que exigem receita médica comercializados nos EUA. A lei prevê:
- O intercâmbio interoperável e eletrônico de declarações transacionais e informações transacionais entre membros de uma cadeia de suprimentos farmacêutica
- O rastreamento interoperável de declarações transacionais e informações transacionais até o fabricante de cada unidade comercializada
- A verificação interoperável do identificador do produto, incluindo número de série, número do lote, GTIN/NDC e data de validade.
O foco aqui está na interoperabilidade. A DSCSA busca proporcionar um fluxo de dados contínuo, seguro e confidencial entre parceiros comerciais.